INFORME DE LABORATORIO VIRTUAL
LEYES DE LOS GASES
I.-LEY DE CHARLES
1.1.- FUNDAMENTACIÓN
Lo que Charles descubrió es que a presión constante, el cociente entre el volumen y la temperatura de una cantidad fija de gas, es igual a una constante.
Matemáticamente podemos expresarlo así:
v= volumen
T= temperatura
K= Constante de presión
1.2.- Práctica: Procesos Isobáricos.
Nos dice que para un gas contenido en un recipiente y al aumentar su temperatura aumenta su volumen y si disminuye su temperatura disminuye su volumen pero con una presión constante el cual es un proceso isobárico.
1.3.- Procedimiento
Sumergir en baño maría un balón de vidrio que contiene aire atmosférico se realiza una conección con el cilindro de vidrio que tiene un embolo lo cual permitir medir el volumen de la temperatura.
Medición inicial .- T= 21.3
V= 250 ml
Y se fue registrando cada dato
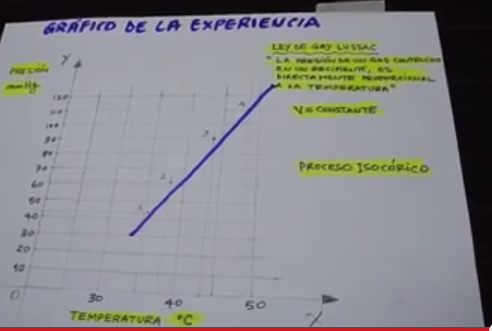
1.4 CONCLUSIÓN
Cuando ya tenemos todos los datos unimos para la gráfica experimental y el resultado es lineal lo cual cumple que el volumen del gas es directamente proporcional a la temperatura